¿QUE ES UN MODELO ATÓMICO?
Cuando hablamos de “modelo” hablamos de una representación o esquema de forma gráfica que nos sirve como referencia para entender algo de forma más sencilla y cuando hablamos de “atómico” hablamos de conceptos relacionados con los átomos. Según esto.
Un modelo atómico es una representación gráfica de la estructura que tienen los átomos. Un modelo atómico representa una explicación o esquema de como son y como se comportan los átomos.
Nombre Autor
|
Modelo Propuesto
|
Conceptos Básicos
|
John Dalton
|
| |
J.J. Thomson
|
| |
E.Rutherford
|
| |
Niels Bohr
|
| |
Schrödinger
|
|
Modelos atómicos
A través de los siglos, el hombre ha especulado acerca de la naturaleza de las partículas esenciales de la materia.
A simple vista, la materia aparece como una masa continua, sin embargo, la evidencia experimental ha probado que está formada por partículas sumamente pequeñas. Estas partículas son los átomos, tienen las propiedades del elemento del que forman parte y están compuestos por partículas más pequeñas.
Tanto los átomos como las partículas subatómicas son tan pequeñas que resulta difícil compararlas con cualquier objeto conocido.

Los físicos han logrado medir el volumen ocupado por una cierta cantidad de átomos y a partir de ahí han logrado calcular el volumen de cada una de las partículas. La unidad que se usa para medir el tamaño de los átomos es el ångström (Å). El tamaño de los átomos varía desde 1 Å para el H2 hasta 5 Å para el átomo de cesio. Para poder llegar a estos conocimientos ha tenido que pasar mucho tiempo y mucha investigación por parte de diversos científicos interesados en el estudio de la materia y en los fenómenos de la misma.

Historia del modelo atómico.Cinco siglos antes de Cristo, los filósofos griegos se preguntaban si la materia podía ser divididaindefinidamente o si llegaría a un punto, que tales partículas, fueran indivisibles. Es así, comoDemócrito formula la teoría de que la materia se compone de partículas indivisibles, a las que llamó átomos. En 1803 el químico inglés John Dalton propone una nueva teoría sobre la constitución de lamateria. Según Dalton toda la materia se podía dividir en dos grandes grupos: los elementos y los compuestos. Los elementos estarían constituidos por unidades fundamentales, que en honor a Demócrito, Dalton denominó átomos. Los compuestos se constituirían de moléculas, cuya estructura viene dada por la unión de átomos en proporciones definidas y constantes.Hacia finales del siglo XIX, se descubrió que los átomos no son indivisibles, pues se componen de varios tipos de partículas elementales. La primera en ser descubierta fue el electrón en el año 1897 por el investigador Sir Joseph Thomson, Posteriormente, Hantaro Nagaoka (1865-1950)durante sus trabajos realizados en Tokio, propone su teoría según la cual los electrones girarían en órbitas alrededor de un cuerpo central cargado positivamente, al igual que los planetas alrededor del Sol. Hoy día sabemos que la carga positiva del átomo se concentra en un denso núcleo muy pequeño, en cuyo alrededor giran los electrones. El núcleo del átomo se descubre gracias a los trabajos realizados en la Universidad de Manchester, El experimento utilizado consistía en dirigir un haz de partículas de cierta energía contra una plancha metálica delgada, de las probabilidades que tal barrera desviara la trayectoria de las partículas, se dedujo la distribución de la carga eléctrica al interior de los átomos.
Modelo Atómico de Dalton. Fue el primer modelo atómico con bases científicas, fue formulado en 1808 por John Dalton, quien imaginaba a los átomos como diminutas esferas. Este primer modelo atómico postulaba: La materia está formada por partículas muy pequeñas llamadas átomos, que son indivisibles y no se pueden destruir. Los átomos de un mismo elemento son iguales entre sí, tienen su propio peso y cualidades propias.


- Modelo Atómico de Thomson. El modelo atómico de Thompson, también conocido como el modelo del puding, es una teoría sobre la estructura atómica propuesta por Joseph John Thompson, descubridor del electrón. En dicho modelo, el átomo está compuesto por electrones de carga negativa en un átomo positivo, como pasas en un puding. Se pensaba que los electrones se distribuían uniformemente alrededor del átomo. Dado que el átomo no deja de ser un sistema material que contiene una cierta cantidad de energía interna, ésta provoca un cierto grado de vibración de los electrones contenidos en la estructura atómica. Desde este punto de vista, puede interpretarse que el modelo atómico de Thompson es un modelo dinámico como consecuencia de la movilidad de los electrones en el seno de la citada estructura.

- . Modelo atómico de Perrin. Modificó el modelo atómico de Thomson, sugiriendo por primera vez que las cargas negativas son externas al "budin". En 1895 el físico francés Jean Baptiste Perrin encontró que los rayos catódicos depositabancarga en un electroscopio, con lo que confirmóque se trataba de partículas cargadas. Fue por aquellas fechas que el inglés Joseph John Thomson se interesó en medir la velocidad de dichas partículas.

- Modelo Atómico de Rutherford. El modelo atómico de Rutherford es un modelo atómico o teoría sobre la estructura interna del átomo propuesto por el químico y físico británico Ernest Rutherford para explicar los resultados de su “experimento de la lámina de oro”, realizado en 1911. El átomo está formado por dos partes: núcleo y corteza. El núcleo es la parte central, de tamaño muy pequeño, donde se encuentra toda la carga positiva y, prácticamente, toda la masa del átomo. Esta carga positiva del núcleo, en la experiencia de la lámina de oro, es la responsable de la desviación de las partículas alfa (también con carga positiva).

- La corteza es casi un espacio vacío, inmenso en relación con las dimensiones del núcleo. Eso explica que lamayor parte de las partículas alfa atraviesan la lámina de oro sin desviarse. Aquí se encuentran los electrones con masa muy pequeña y carga negativa. Como en undiminuto sistema solar, los electrones giran alrededor del núcleo, igual que los planetas alrededor del Sol. Los electrones están ligados al núcleo por la atracción eléctrica entre cargas de signo contrario. El modelo de Rutherford tuvo que ser abandonado, pues el movimiento de los electrones suponía una pérdida continua de energía, por lo tanto, el electrón terminaría describiendo órbitas en espiral, precipitándose finalmente hacia el núcleo. Sin embargo, este modelo sirvió de base para el modelo propuesto por su discípulo Neils Bohr, marcando el inicio del estudio del núcleo atómico, por lo que a Rutherford se le conoce como el padre de la era nuclear.
- Modelo Atómico de Bohr. El físico danés Niels Bohr postula que los electrones giran a grandes velocidades alrededor del núcleo atómico. Los electrones se disponen en diversas órbitas circulares, las cuales determinan diferentes niveles de energía. El electrón puede acceder a un nivel de energía superior, para lo cual necesita "absorber" energía. Para volver a su nivel de energía original es necesario que el electrón emita la energía absorbida, Este modelo, si bien se ha perfeccionado con el tiempo, ha servido de base a la moderna física nuclear. Este propuso una Teoría para describir la estructura atómica del Hidrógeno, que explicaba el espectro de líneas de este elemento.
- Niels Bohr se basó en el átomo de hidrógeno para realizar el modelo que lleva su nombre. Bohr intentaba realizar un modelo atómico capaz de explicar la estabilidad de la materia y los espectros de emisión y absorción discretos que seobservan en los gases. Describió el átomo de hidrógeno con un protón en el núcleo, y girando a su alrededor un electrón. El modelo atómico de Bohr partía conceptualmente del modeloatómico de Rutherford y de las incipientes ideas sobre cuantización que habían surgido unos años antes con las investigaciones de Max Planck y Albert Einstein. Debido a su simplicidad el modelo de Bohr es todavía utilizado frecuentemente como una simplificación de la estructura de la materia.

Modelo atómico de Sommerfeld. En 1916, Arnold Sommerfeld (1868-1951) con la ayuda de la teoría de la reactividad de Albert Einstein (1876-1955) hizo las siguientes modificaciones al modelo de Bohr: a) Los electrones se mueven alrededor del núcleo en orbitas circulares o elípticas. b) A partir del segundo nivel energético existen dos o más subniveles en el mismo nivel. c) El electrón una corriente. Para describir los nuevos subniveles, Sommerfeld introdujo un parámetro llamado numero quántico azimutal, que designo con la letra L. El modelo atómico de Bohr funcionaba muy bien para el átomo de hidrógeno. Sin embargo, en los espectros realizados para átomos de otros elementos se observaba que electrones de un mismo nivel energético tenían distinta energía, mostrando que algo andaba mal en el modelo. conclusión fue que dentro de un mismo nivel energético existían subniveles.
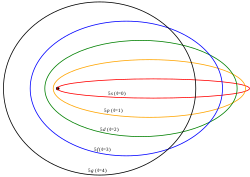

Modelo atómico de Schrödinger. El modelo atómico de Schrödinger es un modelo cuántico no relativista se basa en la solución de la ecuación de Schrödinger paraun potencial electrostático con simetría esférica, llamado también átomo hidrogeno idee.El modelo de Bohr funcionaba muy bien para el átomo de hidrógeno. En los espectros realizados para otros átomos se observaba que electrones de un mismo nivelenergético tenían distinta energía. Algo andaba mal. La conclusión fue que dentro de un mismo nivel energético existían subniveles. En 1916, Arnold Sommerfeld modifica el modelo atómico de Bohr, en el cual los electrones sólo giraban en órbitas circulares, al decir que también podían girar en orbitas elípticas.
Para mayor información consultar estas paginas
Modelos Atómicos
¿Que es un modelo atómico?

Para mayor información consultar estas paginas
Modelos Atómicos
¿Que es un modelo atómico?

excelente información muchas gracias
ResponderEliminarmuy buen análisis de la información prevista
ResponderEliminar